
سولفوریک اسید چیست؟
معرفی سولفوریک اسید
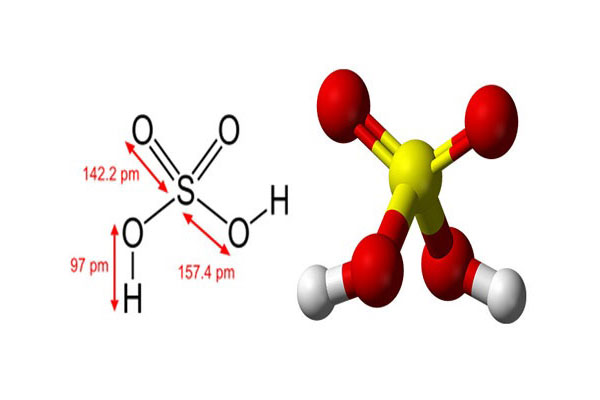
سولفوریک اسید، یک اسید معدنی مایع با فرمول شیمیایی H2SO4 است. این اسید بی رنگ، از گوگرد، هیدروژن و اکسیژن تشکیل شده است که بویی ندارد و خاصیت چسبندگی دارد. اسید سولفوریک به راحتی با آب ترکیب شده و میل به جذب بخار آب آن، زیاد است.
اسید سولفوریک غلیظ نسبت به سنگ ها و فلزات، بسیار خورنده است. زیرا این اسید، یک اکسید کننده با خواص قوی است. پنتوکسید فسفر یک استثنای قابل توجه است زیرا توسط اسید سولفوریک آبگیری نمی شود، بلکه برعکس، اسید سولفوریک را به تری اکسید گوگرد تبدیل می کند.
واکنش اسید سولفوریک و آب، مقدار قابل توجهی گرما آزاد می کند، بنابراین گرماده است. با توجه به این فرآیند، هیچگاه نباید آب به سولفوریک اسید اضافه کرد. زیرا ممکن است با گرمای ایجاد شده، اسید بجوشد و قطرات پخش شده ی اسید، باعث سوختگی شود. در صورت تماس اسید با بافت بدن، می تواند باعث سوختگی شدید شیمیایی اسیدی و حتی سوختگی حرارتی ثانویه به دلیل بخار شدن آب سطح بدن شود. اسید سولفوریک رقیق شده، که خاصیت اکسیداتیو و کم آبی آن کاهش یافته است، خطر کمتری دارد. با این حال، هنوز هم باید با احتیاط از اسیدیته آن استفاده کرد.
جهت خرید مواد شیمیایی اعم از سولفوریک اسید ، تولوئن ، ان هگزان و … می توانید با کارشناسان فروش شرکت شیمی بان تماس بگبرید و از مشاوره رایگان بهره مند شوید .
 تاریخچه
تاریخچه
شیمیدانان اسلامی قرون وسطی مانند جابر بن حیان، ابن سینا (980 – 1037 پس از میلاد) و محمد بن ابراهیم الوطوات، ویتریول را در فهرست طبقه بندی مواد معدنی خود گنجانده اند. شیمیدانان اروپایی قرون وسطی، سولفوریک اسید را “روغن ویتریول” نامیدند.
در قرن هفدهم، یوهان گلوبر، شیمیدان آلمانی-هلندی، اسید سولفوریک را با سوزاندن گوگرد همراه با نمک (نیترات پتاسیم، KNO3) در حضور بخار تهیه کرد. با تجزیه نمک، گوگرد به SO3 اکسید می شود که با آب ترکیب شده و اسید سولفوریک تولید می کند. در سال 1736، جاشوا وارد، داروساز لندنی، از این روش برای شروع اولین تولید اسید سولفوریک در مقیاس بزرگ استفاده کرد.
تولید و ساخت
اسید سولفوریک خالص، به دلیل تمایل زیادی که به آب دارد، به طور طبیعی روی زمین به شکل بی آب یافت نمی شود. اسید سولفوریک رقیق یکی از اجزای تشکیل دهنده باران اسیدی است که از اکسیداسیون اتمسفر دی اکسید گوگرد در حضور آب – یعنی اکسیداسیون اسید سولفوریک – تشکیل می شود. هنگامی که سوخت های حاوی گوگرد مانند زغال سنگ یا نفت سوزانده می شوند، دی اکسید گوگرد محصول جانبی اصلی است (علاوه بر محصولات اصلی اکسید کربن و آب).

در استراتوسفر، لایه دوم جو که معمولا بین 10 تا 50 کیلومتر بالاتر از سطح زمین قرار دارد، اسید سولفوریک از اکسیداسیون دی اکسید گوگرد آتشفشانی توسط رادیکال هیدروکسیل تشکیل می شود. ابرهای دائمی ناهید، باران اسیدی غلیظی تولید می کنند، همانطور که ابر های موجود در جو زمین، باران آب تولید می کنند. همچنین تصور می شود که قمر مشتری، جوی حاوی هیدرات اسید سولفوریک دارد. این اسید، به طور مصنوعی در آزمایشگاه ها، تولید می شود.
 موارد مصرف اسید سولفوریک
موارد مصرف اسید سولفوریک
اسید سولفوریک یک ماده شیمیایی بسیار مهم است و در واقع، تولید اسید سولفوریک یک کشور، نشانگر خوبی برای قدرت صنعتی آن کشور است. تولید جهانی در سال 2004 حدود 180 میلیون تن بود، با توزیع جغرافیایی زیر: آسیا 35٪، آمریکای شمالی (شامل مکزیک) 24٪، آفریقا 11٪، اروپای غربی 10٪، اروپای شرقی و روسیه 10٪، استرالیا و اقیانوسیه. 7 درصد، آمریکای جنوبی 7 درصد.
بیشتر این مقدار (≈60٪) برای کودها، به ویژه سوپر فسفات ها، فسفات آمونیوم و سولفات های آمونیوم مصرف می شود. حدود 20 درصد در صنایع شیمیایی برای تولید مواد شوینده، رزین های مصنوعی، مواد رنگزا، دارویی، کاتالیزورهای نفتی، حشره کش ها و ضد یخ و همچنین در فرآیندهای مختلف مانند اسیدی کردن چاه نفت، کاهش آلومینیوم، اندازه کاغذ و تصفیه آب استفاده می شود.
حدود 6 درصد از کاربرد های سولفوریک اسید، مربوط به رنگدانه ها است و شامل رنگ، لعاب، جوهر چاپ، پارچه های پوشش داده شده و کاغذ می شود. در حالی که مابقی در کاربرد های متعددی مانند تولید مواد منفجره، سلفون، منسوجات استات و ویسکوز، روان کننده ها، غیر قابل استفاده است.




 تاریخچه
تاریخچه موارد مصرف اسید سولفوریک
موارد مصرف اسید سولفوریک









